1 前言 乙醛酸作为的具有醛和羧酸官能团的醛酸,其衍生品种已达数十种,在香料、医学造纸、皮革、塑料、涂料、着色、农药、食品添加剂、有机、生化等多领域均有涉及。但作为强腐蚀性酸,可腐蚀除某些不锈钢合金外的大部分金属品。因此如何高效快速的检测其含量是生产厂家非常关心的问题。该方案是利用上海佳航的JH-T6 全自动电位滴定仪,利用酸碱滴定反应来测定含量,原理如下: NaOOCCOH + Na2SO3 + H2 O → NaOOCH (OH)SO3Na + NaOH 2NaOH + H2SO4 → Na2SO4 + H2 O 多模块加液,避免了更换滴定液的繁琐步骤,耗时少,且避免了人工判断终点带来的主观误差,是检测其含量的优先选择。 2 仪器与设备 2.1 仪器 JH-T6全自动电位滴定仪,复合 PH 电极。 2.2 试剂 NaOH 标准滴定液( 0.3mol/L ), H2 SO4 标准滴定液( 0.2 mol/L ),无水亚*( 126 g/L )。 3 实验方法 3.1实验步骤 1.准备工作 : 1 )配制好 0.3mol/L 的 NaOH 滴定液和 0.2mol/L 的 H2SO4 滴定液分别用烘干后的邻苯
二甲酸氢钾和无水碳酸钠进行标定。 2 )用 PH=4.01、6.86、9.18 的缓冲液校对 PH 电极,以备后续测试。 3 )配制 126g/L 的无水亚*溶液:取 12.6g 无水亚*溶于 100mL 容量瓶中,定容至刻度线。将配制好的亚*溶液,用标定好的 H2 SO4 滴定液滴定至 PH=8.2 以待后续测试。 2.滴定过程: 1 )准确称取 0.5g 乙醛酸试样(精确至 0.0001g ),置于滴定杯中,量取 50mL 去离子水,待溶液混合均匀后,启动方法一用一个滴定单元使用 NaOH 滴定液滴定至 PH=10 ,再启动方法二用第二个滴定单元使用硫酸溶液滴定至 PH=8.2。 2 )滴定完成后,取下滴定杯,量取 10mL 滴定至 PH=8.2 的亚*溶液,加入滴定杯中,然后把滴定杯置于搅拌台上,启动方法二用第二个滴定单元使用硫酸溶液将混合试样滴定至 PH=8.2 ,测试完成。 3.2 参数设置 方法一 : 滴定模式 | 终点滴定 | 滴定前平衡电位 | 6mV | 搅拌速度 | 7 | 结束体积 | 20mL | 快滴体积 | 0.5mL | 慢滴体积 | 0.01mL | 快滴电位平衡时间 | 4s | 快滴平衡电位 | 1mV | 慢滴电位平衡时间 | 4s | 慢滴平衡电位 | 1mV | 滴定终点 | 9.3 | 预控值 | 9.8(延时 15s) |
方法二:
搅拌速度 | 7 | 结束体积 | 20mL | 快滴体积 | 0.5mL | 慢滴体积 | 0.01mL | 快滴电位平衡时间 | 4s | 快滴平衡电位 | 1mV | 慢滴电位平衡时间 | 4s | 慢滴平衡电位 | 1mV | 滴定终点 | 9.3 | 预控值 | 9.8(延时 15s) |
4 结果与讨论 4.1 实验结果 样品名称 | 样品编号 | c(H2SO4) ( mol/L ) | 取样量( g ) | 滴定体积 V1 ( mL ) | 含量( % ) | 平均值( % ) | RSD(%) | 乙醛酸 | 1 | 0.2005 | 0.45659 | 15.410 | 50.1022 | 49.953 | 0.2908 | 2 | 0.51198 | 17.200 | 49.812 | 3 | 0.50410 | 16.960 | 49.945 |
计算公式 : 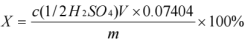 式中: c 是( 1/2H2SO4 )标准溶液的浓度,单位 mol/L; V 是消耗 H2 SO4 滴定剂的体积,单位 mL; m 是称取试样的质量 ,单位 g; 0.07404 是每毫摩尔乙醛酸的质量 ,单位 g/mmol 4.2 图谱 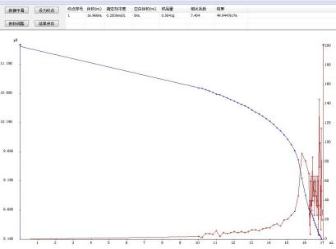
4.3 结论 用JH-T6 全自动电位滴定仪测定乙醛酸的含量结果重复性较好,测定结果都在其标准范围内,JH-T6 全自动电位滴定仪是满足该样品测定需求的。 注意事项: 1. 终点是滴定到确定的某个 PH 值,所以实验前必须先用缓冲溶液校对电极。 2. 保证加入的中性亚*溶液过量。
|  QQ:664521010
QQ:664521010 邮箱:jiahangchn@163.com
邮箱:jiahangchn@163.com 传真:86-021-59904405
传真:86-021-59904405 地址:上海市嘉定区阿克苏南路925弄1号13楼
地址:上海市嘉定区阿克苏南路925弄1号13楼